電池の仕組み
前回の全固体電池の投稿の補足で、電池の仕組みについて簡単にまとめました。
興味がない方はブラウザバックしてください(笑)
電池とは
電池は一次電池と二次電池の2種類あります。
一次電池は放電だけ(電気を取り出すだけ)、二次電池は放電と充電ができます。
初期の電池である、ボルタ電池は一次電池で、スマホに使われるリチウムイオン電池は二次電池です。
また、前回紹介した全固体電池も二次電池です。
「ボルタ電池」「リチウムイオン電池」「全固体電池」の仕組みをざっくりとまとめます。
ボルタ電池は中学3年生の「化学変化とイオン」の「電池」という単元で必ず学習します。この記事を見ていただいている中学生の方は、これだけでも覚えて欲しいと思います。
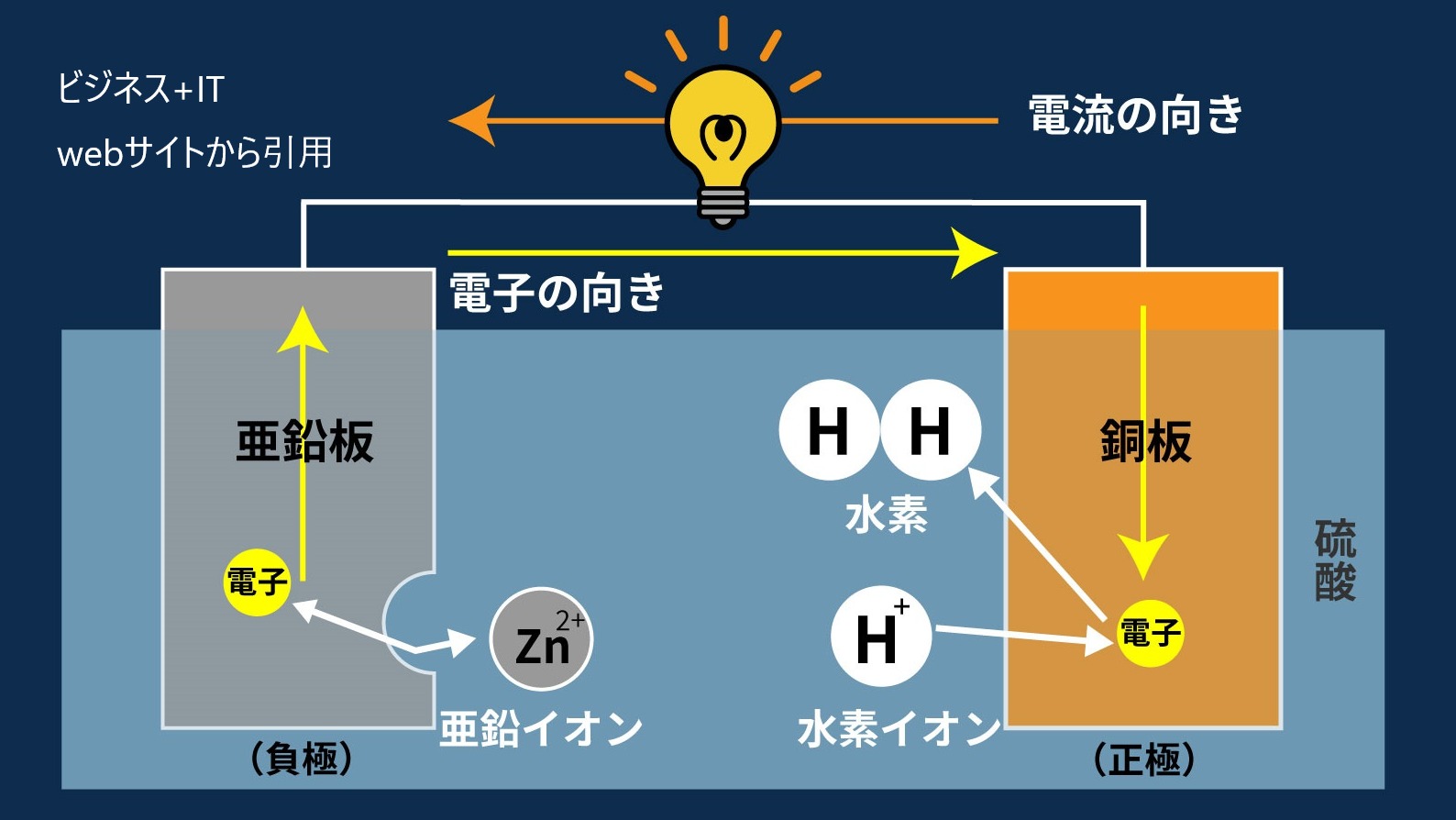
①イオン化傾向の大きい金属板(今回だと亜鉛版)が溶ける。溶けると、亜鉛版は電子を放出し、負(-)極となる。
②前の①で発生した電子がもう片方の金属板の方へ流れる。中学理科で重要なのは、電子の進む方向は電流の向きと逆になることです。
③流れてきた電子が溶液中のイオン化傾向の小さい陽イオン(ここでは水素)とくっつく。また電子の受け取る側は正(+)極となる。
以上の3ステップで、電子が動くと電流が流れます。
ボルタ電池の欠点としては、使い続けるとH₂が銅板のまわりにくっつき、溜まってきてしまいます。すると、水素イオンH⁺が近づけなくなり、電子の受け渡しができず、結果的に、電圧が低下してしまいます。これを分極といいます。
- イオン化傾向はMg>Al>Zn>Fe>Cu(”曲がるぜ鉄道”で覚える)
難しいので覚えなくてよいと思います。
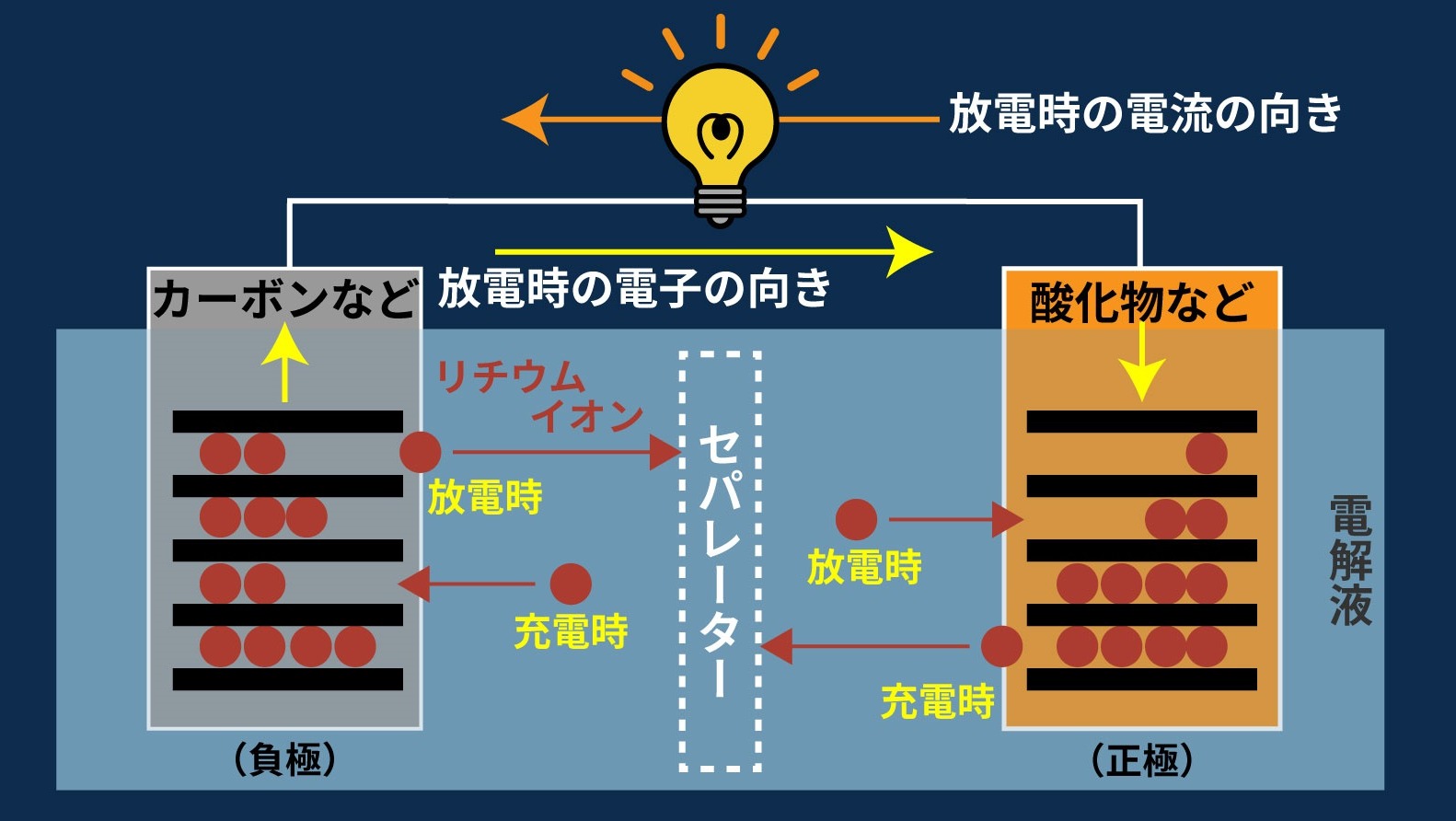
負極から正極へ電子が流れることでリチウムイオンが負極から正極へ移動し、放電が行われます。また、充電時は逆の動きが行われます。
セパレータは活物質(酸化物・カーボンなど)同士の直接接触を防ぎますが、リチウムイオンは通します。
●リチウムイオンの往来によって電流が流れ、図のように電池の劣化が少ない、電圧の低下が少ない、また充電も放電もできます。
難しいので覚えなくてよいと思います。
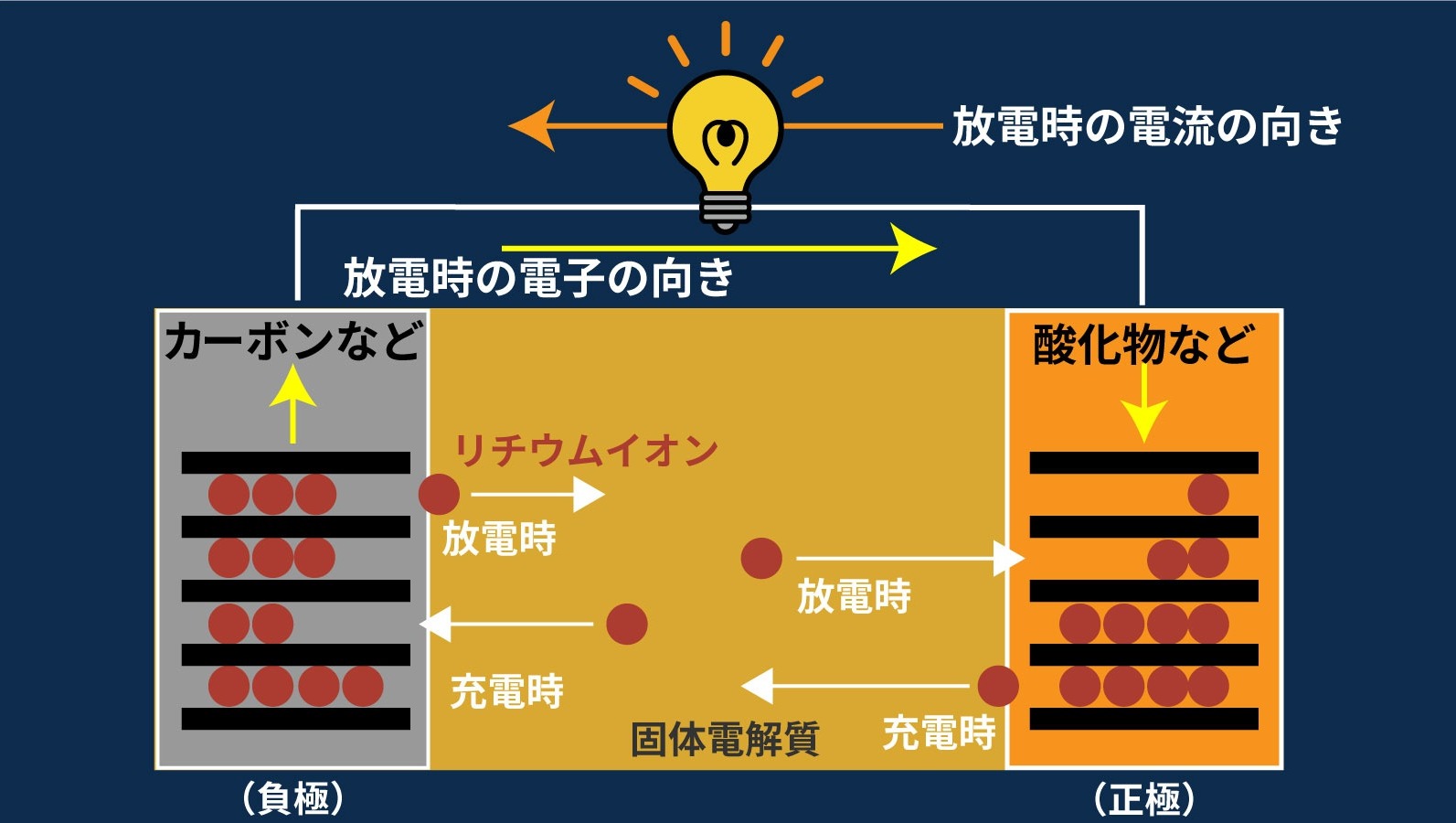
従来のリチウムイオン電池と異なり、イオンの通る電解質に固体を用いています。
活物質が触れ合う恐れがなく、セパレーターを必要としないので、電池を小型化できます。
また、固体電解質は液体に比べ、劣化が少ない、電圧の低下が少ないという特長があります。
電池を小型化するメリット
一つ一つの電池が小さければ、小さな1個の箱の中に多くの電池の層をたくさん積むことができます。
そうすると、電圧が大きくなるため、結果的に、電気をためておく容量が多くなります。
- 容量=電圧×電流
また、これまでにない超小型の電池を作ることができ、新しい電化製品が作ることができます。(コナン君のメガネとか)

まとめ
電池は調べれば調べるほど難しいです。
ただ、ボルタ電池の仕組みは愛知県公立高校入試でよく出ます。
しっかり、理解してほしいと思います。
参考資料:
この記事は「ビジネス+IT」の記事を参考にさせていただきました。


